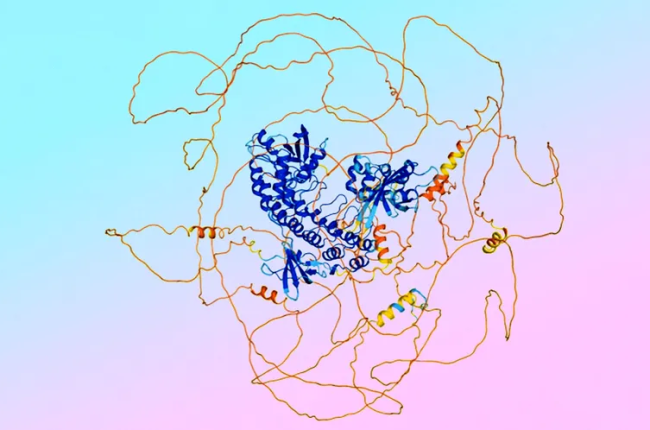
Společnosti Google DeepMind a Isomorphic Labs představily v květnu tohoto roku nový model umělé inteligence AlphaFold 3, který posouvá hranice našeho chápání struktury a interakcí biomolekul. Zatímco předchozí verze AlphaFold 2 se zaměřovala především na predikci struktury proteinů, AlphaFold 3 jde ještě dál a dokáže předpovídat strukturu a interakce všech základních molekul života, včetně DNA, RNA a ligandů.
Tým výzkumníků se rozhodl rozšířit schopnosti modelu poté, co AlphaFold 2 pomohl vědcům předpovědět stovky milionů proteinových struktur. Jonas Adler, výzkumný pracovník Google DeepMind, vysvětluje, že tento krok byl motivován snahou držet krok s nejnovějším vývojem v biologii a chemii.
Jedním z klíčových přínosů AlphaFold 3 je jeho schopnost pracovat s ligandy, které tvoří asi polovinu všech léků. Adrian Stecula z Isomorphic Labs zdůrazňuje obrovský potenciál tohoto modelu pro racionální návrh léčiv a jeho využití v každodenní práci.
Rozšíření modelu o další typy molekul znamenalo výrazné zvýšení možných kombinací. Zatímco proteiny mají omezenou variabilitu (existuje pouze 20 standardních aminokyselin), u malých molekul je prostor variací prakticky nekonečný. To vedlo k vytvoření nástroje AlphaFold Server, který umožňuje vědcům vkládat vlastní sekvence pro generování molekulárních komplexů.
Lindsay Willmore z Google DeepMind přirovnává tento nástroj ke "Google Maps pro molekulární komplexy", kde uživatelé mohou jednoduše vložit sekvence proteinů, DNA, RNA nebo názvy malých molekul a během několika minut získat předpověď jejich struktury.
Pro dosažení těchto pokroků tým výrazně rozšířil datovou sadu, na které byl model trénován. Zároveň došlo ke změně architektury modelu, kdy poslední část využívá generativní model založený na difúzi, podobný moderním modelům pro generování obrazů.
Výzkumníci také museli vyřešit problém s neuspořádanými oblastmi proteinů, které model zpočátku nesprávně interpretoval. Využili proto znalosti z AlphaFold 2 k "destilačnímu tréninku" AlphaFold 3, aby se naučil správně předpovídat i tyto neuspořádané struktury.
Tým je nyní zvědavý, jak vědci využijí AlphaFold 3 k pokroku v oblastech jako je genomický výzkum či návrh léčiv. Jonas Adler uzavírá s nadšením: "Co bylo dříve velmi obtížné, se stalo velmi snadným. Co bylo dříve nemožné, se stalo možným."
AlphaFold 3 tak představuje významný krok vpřed v našem chápání molekulárních struktur a interakcí, otevírající nové možnosti pro vědecký výzkum a vývoj v oblasti biologie a medicíny.
Zdroj: Google